大学化学を学習すると必ずぶち当たる壁の1つがこの「混成軌道」でしょう。もしかしたら高校の段階で学習した人もいるかもしれませんね。深く学習しようと思えばいくらでもできてしまうのですが、今回は単位を取るために必要な基礎だけを見ていきます。

混成軌道って\(sp^3\)混成や\(sp^2\)混成とかのことですよね?メタンやエチレンの例が出てきたのは覚えていますが、それ以上は分かりません。

炭素原子がよく例に出てきますが、他の原子にも適用できます。混成とはそもそもなんなのかというところから見ていきましょう。
【復習】この2つを思い出そう!

\(sp^3\)混成軌道や\(sp^2\)混成軌道を見ていく前に思い出さなければならない知識がいくつかあります。これを理解していないと「?」となってしまうので、しっかり思い出しましょう。
電子軌道とエネルギー準位図
まず1つ目は「電子軌道」と「エネルギー準位図」です。特に、各原子の電子配置からその原子のエネルギー準位図は描けるようになっておきましょう。

何も完璧である必要はありません。なんとなく描けるようになっておけば十分です。とりあえず炭素原子と水素原子だけでも問題はありません。
パウリの排他原理とフントの規則
次に使う知識は上の「エネルギー準位図」と少し被りますが、パウリの排他原理とフントの規則です。つまり、電子軌道が描けたら次は電子を軌道に順番に入れていく必要があるのですが、そのために必要なルールとなっているので合わせて復習しておきましょう。

混成軌道ではフント則をよく使いますね。あまり意識している人はいないかもしれませんが、こちらもなんとなくで十分です。
混成軌道とは?

それでは混成軌道とは何なのか?というところを見ていきましょう。混成軌道にはたくさんの種類がありますが、今回は\(s\)軌道と\(p\)軌道からなる混成軌道を中心に見ていきます。

\(s\)軌道と\(p\)軌道だけでなく、\(d\)軌道まで考えた混成軌道もあるのですが、基本の考え方は同じなので2つだけにします。各軌道の形については下の記事でチェックしましょう。
不対電子の数が合わない
高校化学で学習した炭素原子と水素原子を思い出してみましょう。すべて単結合で結合していると考えると\(CH_4\)となり、中心の炭素原子は結合の手を4本持っていたはずです。

これは高校で学習した内容だから大丈夫です。すべて共有結合でつながっていて炭素原子が中心となる正四面体型をしているんでしたっけ?
さて、このメタンの結合を大学で出てきた電子軌道を使って考えてみましょう。炭素原子は電子を6つもっているので、\(1s\)軌道、\(2s\)軌道、\(2p\)軌道を使ってエネルギー準位図を描いてみると次のようになりますね。
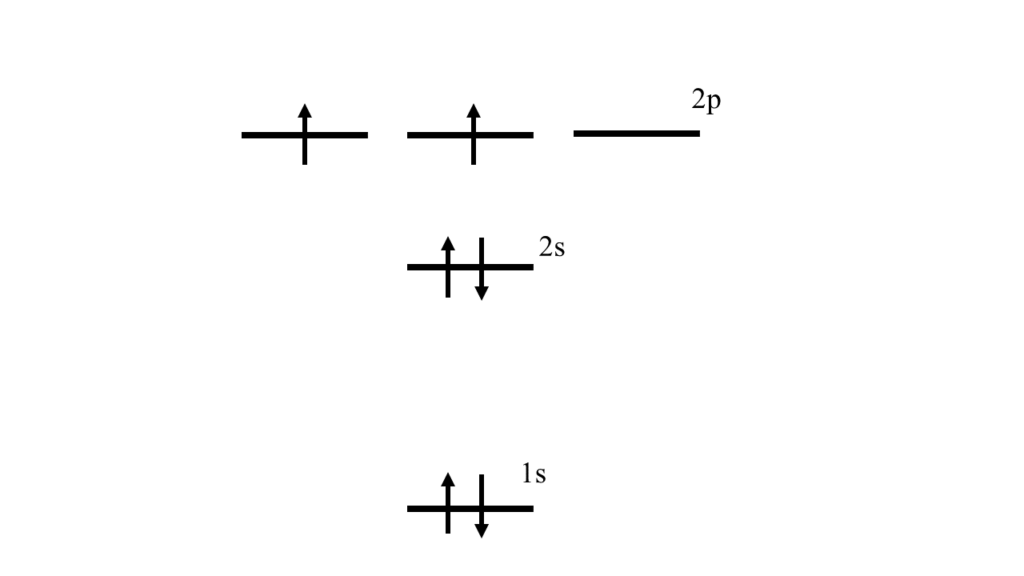

ここで1つ疑問がでてきませんか?共有結合が4本ということは炭素原子は4つの不対電子を持っているはずですね。しかし、この図では4つの電子のうち2つは全く同じ軌道に対になって入っています。

たしかに、共有結合は不対電子をお互いに出し合って結合を作りますから、4つあるはずですね。しかしこの図では不対電子が2つしかないありません。あれ?これでは高校で習った内容と合いませんよ。
軌道の混成
この矛盾を解消するために考え出されたのが「混成軌道」です。つまり不対電子の数を4つにするように軌道を考え直そうというわけです。

高校での学習内容を細かく見ていった結果が電子軌道なはずなのに、それだけでは説明できないなんて変な話ですね。
それではどのように軌道を考え直せば不対電子が4つになるでしょうか?ここで思い出すのが「フントの規則」です。フントの規則のよれば、電子を同じエネルギーの軌道に入れていくときはなるべくペアにならないように入れるのでしたね。

つまり、4つの電子をペアにならないように配置するためには4つの同じエネルギーを持った軌道があればいいのです。
そこで炭素原子の場合では\(2s\)軌道と\(2p\)軌道がそれぞれ独立して4つ存在すると考えるのではなく、\(2s\)軌道の性質を\(\frac{1}{4}\)だけ、\(2p_x\)軌道の性質、\(2p_y\)軌道の性質、\(2p_z\)軌道の性質もそれぞれ\(\frac{1}{4}\)だけ持ったような軌道が4つあるものとして扱おうと考えたわけです。
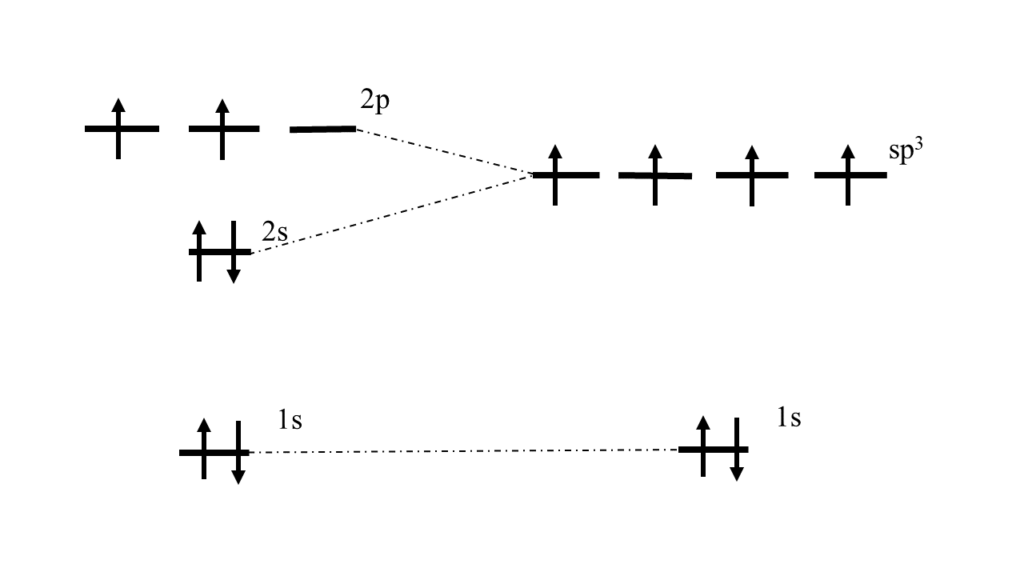

なるほど。画像のように1つの\(s\)軌道と3つの\(p\)軌道を平均化して同じエネルギーの軌道が4つと考えたわけですね。
\(s\)軌道と\(p\)軌道からなる混成軌道
混成軌道を考える理由はすべて同じです。原子のときに考えた電子軌道では結合の説明がつかなさそうだから手を加えるわけですね。

この混成軌道には平均化するのに使う軌道の数によって3種類の軌道が出来るので1つずつ見ていきましょうか。
\(sp^3\)混成軌道
まずは\(sp^3\)混成軌道からです。これは1つの\(s\)軌道と3つの\(p\)軌道を平均化した混成軌道で、炭素原子の場合は\(2s\)軌道と\(2p_x\)軌道、\(2p_y\)軌道、\(2p_z\)軌道ですね。
合計4つの軌道を平均化するので同じエネルギーの軌道は4つできます。また電子同士は反発するのでこの4つの軌道はお互いがなるべく離れた位置に来るように空間的に広がります。

この空間的な広がりは炭素原子を中心とした正四面体型になります。これは高校化学でも学習しますね。

なるほど。それが水素原子と結合するからメタンは正四面体となるわけですね。混成軌道を考えることで形も説明できました。
\(sp^2\)混成軌道
次は\(sp^2\)混成軌道です。これは1つの\(s\)軌道と2つの\(p\)軌道を平均化した混成軌道で、炭素原子の場合では\(2s\)軌道と\(2p_x\)軌道、\(2p_y\)軌道がよく用いられます。

用いる\(2p\)軌道はどれでもいいのですが、教科書等では\(2p_x\)軌道、\(2p_y\)軌道がよく使われています。
この混成軌道は合計3つの軌道が平均化されているので、3つの同じエネルギーを持った軌道が出来ます。また\(2p_z\)軌道は平均化されていませんので、そのままの形で残ります。

つまり\(xyz\)座標で、\(2p_z\)軌道はそのまま\(z\)軸上にあるので、混成軌道は\(xy\)平面上でなるべく離れた位置に来ますね。

分かりましたよ。3つの混成軌道は\(xy\)平面で正三角形型になります。
エチレンを例に取り上げると混成軌道でできた3つの軌道のうち1つが炭素原子間の結合に使われ、残りの2つで水素原子との結合が出来ます。また、残った\(2p_z\)軌道が相互作用しあって炭素原子間の\(\pi\)結合を作ります。

このため二重結合を持つ物質は\(sp^2\)混成軌道を作っている場合が多いです。\(\sigma\)結合や\(\pi\)結合については下の記事を参照しましょう。大きな違いは結合を作る電子軌道の重なりですね。
\(sp\)混成軌道
ここまで理解できればあとは何も難しいことはありません。\(sp^3\)混成軌道や\(sp^2\)混成軌道と同じように考えればいいだけです。\(sp\)混成軌道は1つの\(s\)軌道と1つの\(p\)軌道が平均化された軌道で、炭素原子の場合は\(2s\)軌道と\(2p_x\)軌道ですね。

この混成軌道は\(2p_x\)軌道しか関わっていないので、\(x\)軸方向に伸びた直線状の混成軌道を持ちます。\(2s\)軌道は球状なので軸方向には影響しません。
さらにアセチレンを例に挙げると、残った\(2p_y\)軌道と\(2p_z\)軌道が2つの\(\pi\)結合を作り、混成軌道のうち1つが炭素原子間の\(\sigma\)結合を作ります。そのため三重結合をつくる物質はこの\(sp\)混成軌道をつくっています。
混成軌道の見分け方

ここまでの3つの混成軌道を理解できたなら、見分け方も想像ができるのではないでしょうか?それはズバリ「単結合・二重結合・三重結合のどれを持っているか?」です。もっと細かく言えば、\(\sigma\)結合と\(\pi\)結合がそれぞれいくつあるかということになりますね。

三重結合を持っていれば\(sp\)混成軌道、二重結合なら\(sp^2\)混成軌道、単結合だけなら\(sp^3\)混成軌道ということになります。
\(d\)軌道を考えるとさらにたくさんのパターンや新しい結合である\(\delta\)結合が出てきたりするのですが、ここではやめておきましょう。笑
今回の要点
混成軌道は不対電子の数を合わせるために同じエネルギーを持った軌道を作りたいから考えだされたものでした。また、\(s\)軌道と\(p\)軌道を使った軌道は3パターンありましたね。

そして、それぞれはいくつ\(\sigma\)結合と\(\pi\)結合があるのかで判断できるんでしたよね。でも難しそうなのでとりあえずは結合の種類でいいですか?

そうですね。軌道の重なりから\(\sigma\)結合や\(\pi\)結合が判断できるようになるまでは二重結合や三重結合に注目していけばいいでしょう。
参考文献
量子化学ー基礎からのアプローチ(真船 文隆)
詳解 量子化学の基礎(類家 正稔)
はじめての量子化学 量子力学が解き明かす化学の仕組み(平山 令明)






コメント