今回は\(1s\)軌道や\(2p\)軌道といった軌道間の関係についてみていきましょう。この軌道間の関係性が理解できると、今後の量子化学や物理化学分野の学習が捗ること間違いなしですよ。

ぜひ軌道や量子数の話と組み合わせて理解しましょう。また、高校物理で学習する電磁気の基礎知識もあると便利です。
【復習】クーロン力のポテンシャル


たしかポテンシャルは高校物理でいうところの位置エネルギーでしたよね。ということは電磁気力の位置エネルギーに当たるものが出てくるんですか?
まずは高校物理で学習したクーロン力を復習しましょう。クーロン力とは電荷を持った物体同士に働く斥力または引力でしたよね。そしてその力\(F\)は下の式のようにあらわすことができました。
$$F=\frac{1}{4\pi\epsilon_0}\frac{q_1q_2}{r^2}$$
またこの式からクーロン力によるポテンシャルを導出できますね。具体的には\(r\)について積分すればOKです。つまり、ある位置から別のある位置まで移動させるのに必要なエネルギーがポテンシャルに当たるので、これらを微小区間で区切って全部足し合わせれば良いわけです。
$$U=\int \frac{1}{4\pi\epsilon_0}\frac{q_1q_2}{r^2}dr$$
$$=\frac{1}{4\pi\epsilon_0}\frac{q_1q_2}{r}$$

この式から符号の異なる電荷が1つずつある場合はポテンシャルはマイナス、つまり安定化することがわかりますね。この安定化が重要になります。
軌道と原子核の距離

軌道といってもはっきりとした「電子が通る道」のようなものがあるわけではなく、電子の存在確率が高い場所をそう呼んでいるのでしたね。軌道と波動関数、存在確率との関係性は以下をチェックしましょう!

確か軌道の形は同じでも、原点からの距離によって存在確率が高くなったり低くなったりするんでしたっけ?

つまり、各々の軌道によって電子の存在確率が高くなるような原子核からの距離が違うということです。これをさっきのクーロンポテンシャルと合わせて考えてみましょうか。
軌道の安定化
さて、ある軌道に存在する電子を考えてみましょう。このとき、この電子の持つ全エネルギーは原子核と電子の引力によって安定化され、引力がない場合に比べて小さくなります。
一方で別の軌道に入った電子を考えてみましょうか。別の軌道上にある電子なのですからもちろん原子核との距離も先ほど考えていた電子とは違ってきます。

ということはクーロン力によるポテンシャルも2つの電子では違ってきますね。

正解です。このような理由から、軌道が違えばその分電子が持つエネルギーも異なるのです。そのため、どの軌道がどのようなエネルギーに対応するのかが大体わかります。
このようなエネルギーの違いがみられることは実はかなり奥深いことなのです。実験的には水素原子のスペクトル線のライマン系列やバルマー系列から観察できます。この軌道によるエネルギーの違いからどんどん話が広がっていきます。
とびとびのスペクトル線
少し脱線して、シュレディンガー方程式などの話が始まる以前まで時をさかのぼります。ある科学者が水素原子の発光スペクトルを観察したところ、特定の波長の光だけが出てくる線スペクトルが結果として得られました。
パブリック・ドメイン,リンクによる wikipedia バルマー系列より引用
これは後の時代になって電子が軌道間を移動する影響であることが解明されます。光の波長はエネルギーに対応するので、この実験からも電子が取りうるエネルギーがとびとびであることや軌道によってエネルギーが違うことがわかりますね。もし、連続的なエネルギー変化であれば虹色のようにたくさんの波長の光が放出されるはずです。
軌道間のエネルギー差

軌道間にエネルギー差があることはここまでの話で分かりましたか?このエネルギー差からどんどん話が広がっていくといいましたが、実際に見ていきましょうか。

その軌道間のエネルギー差が具体的にどんな役割を果たすの?

それではいくつか見ていきましょう!
エネルギー差が重要なワケ
みなさんは化学反応というものがなぜ起こるのか、なぜ進行するのかについて高校で学習したはずです。それは反応物と生成物のエネルギー差に関係していたはずです。ここでは具体的に目にする機会の多い反応について書き並べてみました。軌道を用いた考え方を少しだけ載せているので、イメージしてみましょう。詳細な解説はまたの機会に行うとして、「こんな現象があるよ」くらいに思っていてください。
酸化・還元反応
まず1つ目は酸化・還元反応です。酸化・還元反応は中学でも高校でも扱いますよね。実はこれも軌道間のエネルギー差に由来します。

酸化・還元反応が電子の受け渡しの反応であることを思い出しましょう。軌道間のエネルギー値に差があると、電子は少しでも安定な方へ移行しますから、電子の受け渡しが起こります。
実際はこんなに簡単ではありませんが、比較的イメージは付きやすいのではないでしょうか?そのため、原子や分子がイオンになるだけで酸化力が大きく変化することもあります。ちなみにほとんどすべての化学種では一番エネルギーの高い軌道に入った電子が移動します。これは最も不安定な電子が反応しやすいからです。

安定化されている電子はその分反応させるのにも一苦労ですからね。不安定な電子が多いほど反応性は高いというわけです。そのために、1番エネルギーが高い電子が充填されている軌道が変化すると酸化力が大きく変化します。
求核剤・求電子剤
上の酸化・還元反応が理解できればこの求核剤・求電子剤の考えはすんなりと理解できるでしょう。結局これも有機化学バージョンの酸化・還元反応と似通ったものですからね。

求核剤って原子核のような正電荷のお話じゃないんですか?ここに電子がなぜ関わってくるのかイマイチわかりません。

求核剤は「正電荷を欲する」ような物質ということです。つまり自身は電子をたくさん持っているような物質なので、「電子を与える能力」とみれば還元剤と同じように考えることが出来ます。
吸光・蛍光・りん光
最後にもう1つ紹介しましょう。光を原子や分子に当てると、原子や分子は当てられた光の一部を吸収してしまいます。この吸収した光もエネルギーを持っていますから、原子や分子はそのエネルギーを受け取ったことになりますね。

え?そのエネルギーはどこに行くんですか?

この時に受け取ったエネルギーを使って、原子や分子中のよりエネルギーの高い軌道へ電子が移動するんですよ。なんだか不思議な感じがしますけどね。
逆にエネルギーを放出してよりエネルギーの低い軌道へ電子が移動することもあります。この時に放出されたエネルギーは光として放出されるのですが、この光のことを蛍光やりん光と言ったりします。

細かい区別といった詳細はまたいずれ解説することにしましょう。蛍光灯はこの原理を利用して光っています。
エネルギーの大きさ
このエネルギー差を図で表すととても便利なのですが、そのためにはある程度軌道のエネルギーの大きさについて順番を知っていなければなりません。ここでは詳しい順番は割愛しますが、おおまかには以下の軌道エネルギーの順番を覚えておけば問題ないでしょう。
$$1s<2s<2p<3s<3p<4s<3d<…$$
エネルギー準位図
上の軌道エネルギーを用いて、軌道のエネルギーをグラフ化してみましょう。そうすればどことどこの軌道間のエネルギー差が大きいのか小さいのかが一目でわかります。

確かに、数字で言われてもあまりピンときませんからね。グラフで表してくれるとありがたいです。
このために使われる図が「エネルギー準位図」といいます。縦軸にエネルギー\(E\)を取ったグラフで、大学の化学の教科書にはよく出てくる図ですね。それではエネルギー準位図のおおまかな描き方を見ていきましょう。
描き出す軌道をピックアップ
どこの範囲までの軌道を描き出すのかを考えましょう。ノープランで描いてしまうと意外と図が枠に収まらなかったり、逆に小さすぎてごちゃごちゃしてしまうといったことも…。
軌道を示す横線を描く
描き出す軌道が決まったら軌道を示す線を描き入れましょう。この時、どこに描いてよいわけではありません。ここまで見てきたように軌道ごとにエネルギーが決まっていますので、ある程度は意識しましょう。
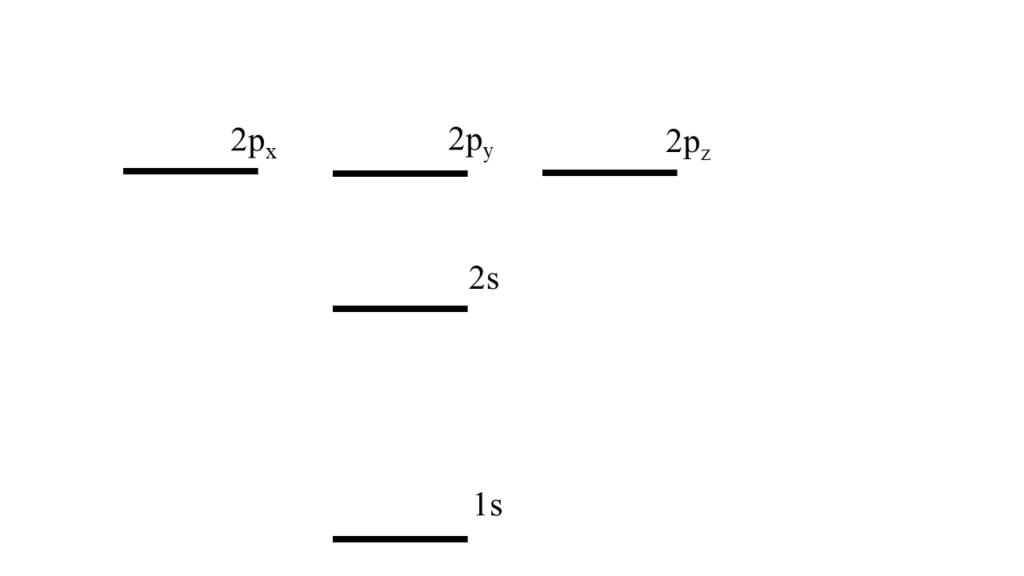

グラフの軸にはちゃんとした値を取った方が良いですか?

いいえ、適当で大丈夫です。ただし、\(s\)軌道を\(p\)軌道と同じ位置に描いたりしないように、最低限はエネルギーの大小の位置関係を守りましょう。
電子を描き入れる
軌道が描けたら「パウリの排他原理」と「フント則」に従って電子を順番に詰めていきましょう。この2つは以下の記事で解説しているので忘れた人はチェックしましょう。
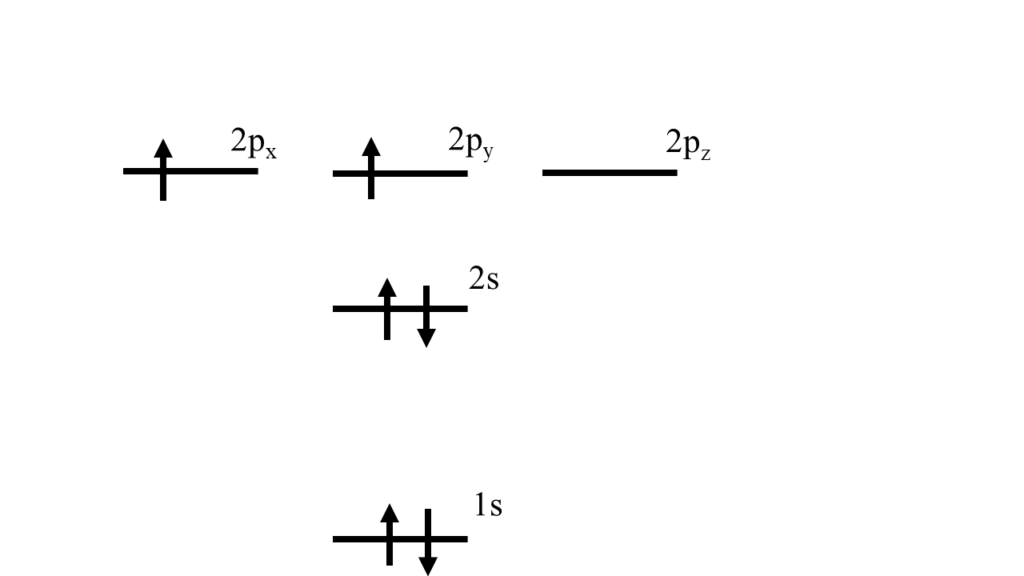

ちなみに\(2p\)軌道の電子は3つとも同じエネルギーなのでどこに入れてもいいのですが、今回は\(2p_x\)と\(2p_y\)に入れています。

これでエネルギー準位図の基本は完成です。ただし、この図は分子軌道図やヤブロンスキー図といったように用途によって様々な形に変換されます。あくまで今回のものは基本ですよ。
今回の要点
今回は電子軌道のエネルギーに差があるということ、その差をグラフとして示す方法の1つとしてエネルギー準位図の描き方を見てきました。

このエネルギー準位図は今後よく出てくるのでしっかり押さえておきましょう。これを避けて化学は学べません!笑
参考文献
量子化学ー基礎からのアプローチ(真船 文隆)
詳解 量子化学の基礎(類家 正稔)
はじめての量子化学 量子力学が解き明かす化学の仕組み(平山 令明)






コメント