大学もテスト前になり、「結合性軌道」や「反結合性軌道」といった用語や、原子軌道・分子軌道の概念に振り回されている人も多いでしょう。

確かに\(s\)軌道や\(p\)軌道まではなんとか理解できたんですけど、そのあとに分子軌道が出てきて訳分からなくなってしまいました。

確かに分子軌道は、いくつかの原子軌道を組み合わせた結果を考えるので、その分難しいです。
今回は、そんな時間の無いあなたに「分子軌道」をとても分かりやすくかつしっかり理解できるようにお話ししていきます!まずは少し原子軌道の復習をしてから本題に入っていきましょう。
【復習】原子軌道を思い出そう!

分子軌道のお話に入る前にまずは原子軌道についての理解を深めていきます。原子がくっついて分子ができるように、分子軌道も原子軌道が組み合わさった結果できるものなので、原子軌道を理解することが最初の第1歩となります。
電子を見いだす確率の高い場所
波動関数の2乗が電子を見いだす確率と密接に関係していることはもうすでに何度もお話してきたので、大丈夫だと思います。

あ、それは覚えています!波動関数の意味を解説したときと\(s\)軌道とか\(p\)軌道を解説したときに出てきたお話ですよね。
この時、電子の存在確率がある一定値よりも高い部分に注目したのが原子軌道でした。例えば\(s\)軌道や\(p\)軌道といったものがありましたよね?
原子軌道の相互作用
さて、次に原子がいくつか組み合わさって分子を作る場合を考えてみましょう。例えば、2つの原子が近づくとそれぞれの原子が持つ「原子軌道」が相互作用を起こし、新しい軌道が形成されます。

この新しく形成される軌道がいわゆる分子軌道です。ということで、全く新しいものというよりは2つ以上の原子軌道の組み合わせといった方が近いですね。
分子軌道のでき方と原子軌道との関係が少し理解できたところで、いよいよ分子軌道の中の「結合性軌道」や「反結合性軌道」についてみていきます。

高校物理の波動で学習した知識と高校化学で学習した共有結合の知識から出発していきますので、思っているよりも簡単なお話ですよ。
電子の存在確率は強め合うし弱め合う

電子の存在確率を表すのは波動関数でしたよね?ここまでなんとなくの理解で進めてきましたが、波動関数と呼ばれるからには、この関数は波の性質を持っています。

まあ、強いて言えば「電子が持つ波動性と粒子性」について解説したときに、波の性質については出てきましたよね。今回は波の性質について焦点を当てていきます。
波の強め合い・弱め合い
高校物理で学習した波動では、2つの波が出会うとお互いに「強め合う」または「弱め合う」といったことを起こすと学習しました。この時、強め合う場合と弱め合う場合では何が違うのでしょうか?

たしか、2つの波の位相が一致する場合はお互いに強め合って、位相が逆の場合は弱め合うんでしたっけ?

その通りです。そしてこれは電子を表す波動関数でも同じ考え方が適用できます。つまり、波動関数の位相が同じであれば存在確率が強め合うことで元の値より大きくなり、逆の場合には弱め合うことで存在確率は小さくなります。
つまり、原子軌道(\(s\)軌道や\(p\)軌道)に入っている電子の波動関数の位相が同じであれば、電子の存在確率が大きくなり、逆位相なら小さくなるということになります。
波動関数の位相とは?
これまでの話から、位相さえ分かれば電子の存在確率が大きくなるのか、小さくなるのかがわかるということになりますね。さて、波動関数の位相はどこに書かれているのでしょうか?

確かにそうですね。あ、もしかしてシュレディンガー方程式のように何かの演算子を作用させて計算したら出てくるとか?

考え方はすごく良いですが、そんなに難しいことではありません。\(s\)軌道や\(p\)軌道を学習した際に、赤色と青色の軌道があったのを覚えていますか?
この軌道に付けられた色が波動関数の位相を表しています。つまり色が一致している軌道は位相が同じであり、違っていれば位相が異なるということになります。
ここまでをまとめると、色が一致した軌道同士が相互作用する場合には電子の存在確率が大きくなり、逆に色が異なる軌道同士が相互作用する場合には電子の存在確率は小さくなります。
分子軌道とエネルギーの変化

ここからは新しくできた分子軌道とエネルギーの関係性を考えていきます。高校化学で学習した共有結合の仕組みをおさらいした上で話を進めていきましょう。

分子軌道もエネルギー準位図を用いてお話していきます。少し長くなりますが、頑張っていきましょう!
【高校化学】共有結合の強さと電子
高校化学を復習していきましょう。例えば原子2つが共有結合をつくるとき、その原子に含まれている電子はどこにあるでしょうか?

えーっと。たしか、その共有結合をつくる原子の間にあって、2つの原子をくっつける働きをしているんでしたっけ?

大正解です!そして、ここから分かるのは2つの原子の間に電子があると共有結合が強くなる、つまり分子が安定化されるということです。
波動関数の強め合いと軌道
今のお話を先ほどの波動関数の強め合いと合わせて考えていきましょう。

波動関数は位相が同じであれば強め合って、逆なら弱め合うということと2つの原子間に電子があれば分子が安定化するということですか?

まさにその2つです!この事実から2原子分子の軌道まで持っていきますよ。
2つの原子が近づくと、原子軌道同士が相互作用を起こして新たな軌道ができるということはすでにお話しましたね。そしてこの原子軌道には「位相」がありました。
原子軌道の持つ「位相」によって新しくできる分子の安定性が決まります。つまり、2つの原子軌道が同じ位相であれば、分子は安定化しますし、逆の位相であれば不安定化します。

共有結合と組み合わせて考えると良いでしょう。つまり、位相が同じであれば波動関数が強め合い、その結果として2つの原子間の電子密度が増加するために安定化するというわけです。
このように考えれば少しは高校化学で学習した「共有結合と電子の関係性」と大学で学習する「電子と波動関数」のつながり、そして分子軌道の考え方が理解できるのではないでしょうか?
2原子分子のエネルギー準位図
最後に、\(s\)軌道だけを持つ2つの原子が分子になる場合の分子軌道準位図を見てみましょう。

考える軌道を\(s\)軌道に限定するのは、複雑すぎるからです。\(p\)軌道や\(d\)軌道は\(s\)軌道に比べたら形や位相も複雑なので、今回は省いています。
エネルギー準位図の基本的な描き方は下の記事を参考にしましょう。下記記事内では原子の軌道について考えていますが、今回は分子の軌道を考えていきます。
分子軌道準位図は左右の両端に原子状態での原子軌道を描き、その中心に相互作用した後に新しくできた分子軌道を描きます。今回は\(s\)軌道しか考えないので、両端には\(s\)軌道1つしか描きません。
次にこの\(s\)軌道の相互作用を考えるわけですが、\(s\)軌道は位相が1種類しかないので、「2つの原子軌道の位相が同じ場合」と「2つの原子軌道の位相が異なる場合」の2パターンを考えればOKそうですね。

\(s\)軌道は軌道全体で1つの位相、つまり全体が\(+\)または全体が\(-\)のどちらかしかありません。そのため、2パターンの組み合わせしかないということです。
このようにして考えた分子軌道準位図は下のようになります。
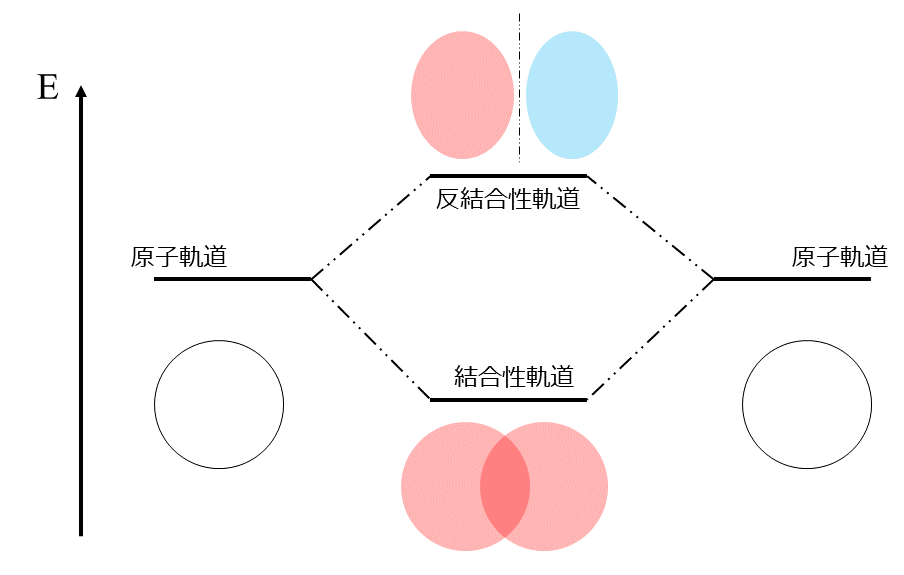

ああ、なるほど。このエネルギーがちょっと上に行ったり、下に行ったりしているのがそれぞれ安定化と不安定化を示しているってことですよね?

その通りです。安定化した軌道が波動関数が強め合った軌道、不安定化した軌道が弱め合った軌道に対応しています。
安定化した軌道は電子密度の増加させる影響をもたらすため、原子同士の結合を強くする働きがあるということになります。このような軌道を「結合性軌道」といいます。一方で、電子密度を減少させることで結合を弱くする働きをする軌道を「反結合性軌道」といいます。
つまり結合性軌道に電子が入ると結合は強くなり、反結合性軌道に電子が入ると結合は弱くなります。これを指標とした数字が「結合次数」です。まあ、長くなってしまったので結合次数についてはまたの機会にしておきましょう。
今日の要点
今回は原子軌道が相互作用した結果、新たに形成される分子軌道についてみてきました。一見難しそうに見えますが、軌道の符号と高校化学で学習した共有結合の基礎を思い出せば分かることも多いです。

まあ、\(s\)軌道以外を考えるときはもっとしっかり理解しないといけません。今回は数式等を一切使わず、「なんとなく理解」を目指したものになっています。
分子軌道には波動関数の位相の違いによって、「結合性軌道」と「反結合性軌道」の2種類ができるということも分かりましたね。もし余裕がある場合には量子化学の教科書を開いて、数式上での理解や他の軌道の相互作用についても勉強すると面白いですよ。





コメント