以前の蛍光とりん光について解説した記事で、励起状態からエネルギーを失う過程が蛍光やりん光を放出する以外にも実はたくさんあるとお話したことを覚えていますか?

そういえば最後にたくさんあるって聞いて覚えるのを諦めかけた記憶があります。

そういえばそうでしたね。でも諦めるのはまだ早いですよ。今回のお話を聞いてその難しそうな部分を一気に解決しちゃいましょう!

あ、もしかしていろいろな過程を1枚の図にまとめたってやつですか?たしかヤブロンスキー図とかって言ってしたよね。
今回は「ヤブロンスキー図」についての解説です。何度も言うように励起状態の分子は蛍光やりん光といった光を放出するだけでなく、実際は様々な過程でエネルギーを失います。それらすべてを1枚の図でしっかり理解しましょう!
エネルギーを失う過程

まずは蛍光とりん光の放出以外で励起状態の分子がそのエネルギーを失う過程をいくつか順番に見ていきます。今回取り上げるのは3種類なので、それぞれしっかり理解しましょう。

3種類とはいってもそれぞれ特徴がかなり異なるものですので、どういう性質のものでどの状態からどの状態へ変化するのかに注目しましょう。

それら3つを解説してから図示するんですね。頑張ります…。
振動緩和
まずは振動緩和から見ていきます。その名の通り「振動準位」に関連したエネルギーを失う過程です。振動準位については下に記事を参考にしましょう。ミクロな視点で見ると実は電子状態だけでなく、分子の振動運動も量子化されているのです。
分子の振動運動の例を1つ挙げると、2原子分子の伸縮運動が挙げられます。これは2つの原子間の結合が伸びたり縮んだりするような振動運動であり、この運動が量子数\(n\)が含まれた電子状態の波動関数と同じように、振動の量子数を用いた振動の波動関数というもので記述できるということです。

まあ、とりあえずは振動の量子数が増加すると振動運動が段階的に激しくなるくらいの認識でOKです。これが振動緩和の鍵となってきます。
分子に光をあてると励起状態になりますが、このとき振動の量子数も一緒に\(0\)ではない\(2\)や\(3\)といった値をとることがあります。つまり分子は「電子励起状態が持つエネルギー」と「振動運動が持つエネルギー」の2つを持っていると考えられます。

あ、このうち「電子励起状態が持つエネルギー」の失い方は以前の記事でお話してくれた蛍光とりん光ですね。
そして、この2種類のエネルギーのうち「振動運動が持つエネルギー」を失うときの過程が「振動緩和」です。よく出てくるパターンとして分子が励起された後、非常に早い振動緩和が起きることで「振動運動が持つエネルギー」が0になるというものです。

これは後半の図中にも出てくるのでしっかり覚えておきましょう。
内部転換
次に見ていくのは「内部転換」です。先ほどの振動緩和に関係があるので先ほどの話も思い返しながら解説していきます。
振動緩和の話の際に、分子は「電子励起状態が持つエネルギー」と「振動運動が持つエネルギー」の2つを持つことをお話しましたが、この「振動運動が持つエネルギー」とはどこまで大きくなるでしょうか?

え?どこまで大きくなるか?

極端な例を言うと、振動の量子数が100や200となると「振動状態が持つエネルギー」がかなり大きなエネルギーになると考えられませんか?
一般的には量子数が\(1\)違う状態同士を比べるとその差は「振動状態同士」よりも「電子励起状態同士」の方が大きいです。つまりある準位から次の準位へ移動するのに、振動状態よりも電子励起状態の方がより大きなエネルギーが必要ということです。
しかし、振動状態に関しても先ほどの質問通り量子数を大きくすればいずれ電子励起状態の2段目と同じくらいのエネルギーを持つことがあります。

なるほど…。つまり励起状態では2段目に行くのもかなり高いけれども、振動状態でも50段や100段上ればそれと同じ高さになるところがいずれ来るということですよね。
分子はこのように同じようなエネルギーを持っているとこの階段を乗り移ることがあります。1段1段の差が大きい階段から1段1段が細かく分かれている階段へ乗り移るイメージです。

あ、なんとなく理解できました。つまり「励起状態が持つエネルギー」が0になってその分「振動運動が持つエネルギー」に変換されるということですね。
項間交差
最後は「項間交差」です。これはエネルギーを失う過程ではないですが、ヤブロンスキー図には出てくるものなので解説します。
項間交差はスピン軌道相互作用という働きによって電子のスピンが変化することで起こります。そしてこのスピン軌道相互作用はハロゲン原子等が含まれていると起こりやすくなります。

あ、以前聞いた「りん光」の解説で同じことを聞いたような…
項間交差を起こすとりん光を放出する前の状態へと変化します。要するにりん光の放出直前のスピンの向きが変化した状態の事です。この状態を三重項状態といいますが、細かい解説はまた別の機会に行いましょう。

ここでは、三重項状態というものがあってそれは電子スピンが変化した結果生まれたものくらいの理解で良いでしょう。
ヤブロンスキー図

ここまで理解してようやく今回のタイトルにもある「ヤブロンスキー図」を見ていきましょう。この図は励起分子が通りうるエネルギーを失うようなたくさんの過程を簡単な図で表したものです。

ここまで結構いろいろ出てきたので、簡単な図にしてくれるのは凄くありがたいです。蛍光とりん光、そしてその他の過程が3つでしたよね?
ヤブロンスキー図
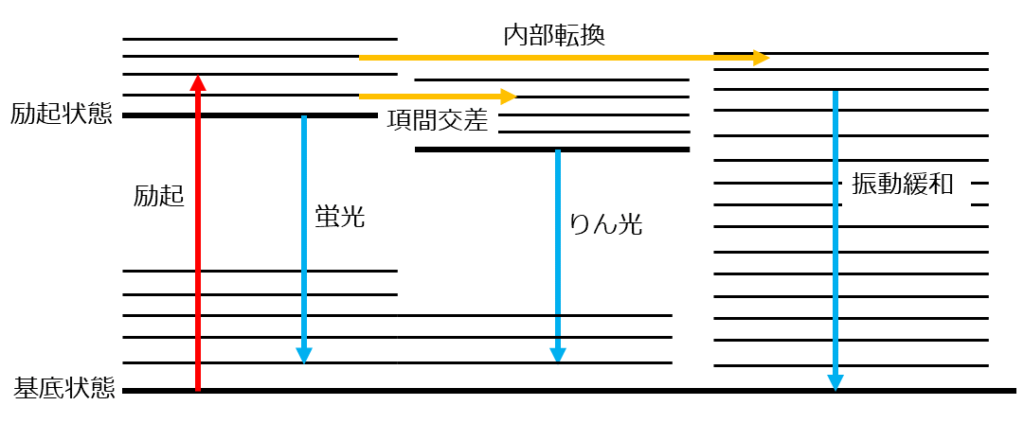

なんか線やら矢印やらたくさんあって意外と難しそう…

たしかに始めてみると難しそうに感じますよね。しかし1つ1つが表していることは全部これまでに聞いたことあるものばかりです。
図の見方
それではそれぞれを簡単に説明していきます。まず、水平に引かれた線がエネルギー準位図を表しています。太い線が電子状態のエネルギー準位、比較的細い線が振動状態のエネルギー準位を表します。

ここでは電子状態と振動状態しか描かれていませんが、実際は回転状態のエネルギー準位も存在します。しかし、一般的には省略されるのでまずは2つを覚えましょう。
次に矢印についてですが、これはエネルギーの出入りを表します。上向きは吸光のように分子がエネルギーを得る過程、下向きは蛍光やりん光といった分子がエネルギーを失う過程を示します。また、横向きはエネルギー値は変化しない一方で、状態だけが変化するような過程です。

あ、たしかさっき出てきた内部転換や項間交差でしたよね。
これを見れば、一目で分子がどのような電子状態、振動状態の変化を経るのかが理解できます。教科書にもテストにも出てくる図になりますので、しっかり見方を理解しておきましょう。
今日の要点

今回はヤブロンスキー図の見方とそれに含まれる励起状態の分子の変化を見てきました。結構多くて覚えるのが大変だったと思います。また、図中の矢印の向きによって分子が持つエネルギー変化も捉えられることが分かったと思います。

今回は、ヤブロンスキー図の見方さえ理解してくれればOKです。なぜそのようなことが起こるのかといった理由はまたの機会の解説しますが、各過程の名前についても把握はしておきましょう。

えー。まだまだ続くんですか?もう結構おなかいっぱいですよ…

まあまあそんなこと言わずに、今後しっかり1つ1つ見ていきましょうね笑
ヤブロンスキー図は先ほども言った通り、教科書だけでなくいろいろなところで見る機会の多い図なので、しっかり理解しておいて損はないと思いますよ。






コメント